
2020年9月30日,美国FDA授予泛生子(纳斯达克代码:GTH)肝细胞癌早筛液体活检产品HCCscreenTM“突破性医疗器械”(Breakthrough Device Designation)认定,将极大加速HCCscreenTM在美国的研发和审查进程,并且该产品在获批后可被医保覆盖达成大规模临床应用。非常值得关注的是,该认定在国内肿瘤精准医疗领域乃至整个诊断行业尚属首例。
什么是“突破性医疗器械”认定?
根据FDA于2018年12月发布的针对突破性医疗器械计划的最终指南,“突破性医疗器械”及配套的突破性医疗器械计划(Breakthrough Devices Program,BDP)旨在加速创新型产品的开发、评估和审查过程,使患者能够更早地使用这些产品。只有那些能够更有效地诊断或治疗危及生命的或不可逆转的使人衰弱疾病的医疗器械才能获得FDA认定为“突破性医疗器械”[1]。并且通过认定的医疗器械必须代表着突破性的技术,在市面上没有已经获批的替代产品,或者相比现有的技术方案有着显著优势(图1)。

图1. “突破性医疗器械”认定的条件。
值得注意的是,“突破性医疗器械计划”并不仅仅是为通过认定的产品提供一个“优先权”或“快速通道”,而是通过覆盖整个上市周期的制度设计,助推那些对临床有重要价值的创新产品尽快上市并大范围应用。具体来说,美国FDA为器械制造商提供了与审评专家进行注册前频繁、深度沟通的机会,及时、全面、有效地协商、确定确保顺利通过FDA审批的产品验证实验方案。通过“突破性医疗器械”审查的产品可以进行优先审评,并可以通过冲刺会议(sprint discussion)与审评团队在规定的时间(45天)内就特定的议题形成时间表并最终达成一致意见。借助数据研发计划(Data Development Plan,DDP),制造商与审评团队对上市前后的临床数据进行分配,进而加强此类医疗器械的全生命周期监管[2]。也正是由于这些价值巨大的“认定大礼包”覆盖太多资源,“突破性医疗器械”申请厂家越来越多,审批认定的门槛不断提高,难度不断升级,FDA在此也越来越“吝啬”。
为什么肝癌早筛产品HCCscreenTM能够获得“突破性医疗器械”认定?
“突破性医疗器械”计划的实施,有效促进了突破性产品在临床的落地应用。此前行业内泰斗级企业Foundation Medicine的大panel伴随诊断产品FoundatoinOne CDx也曾在获批前获得该认定。在肿瘤早筛领域,其中一些曾获得过该认定的美国顶级的早筛公司:
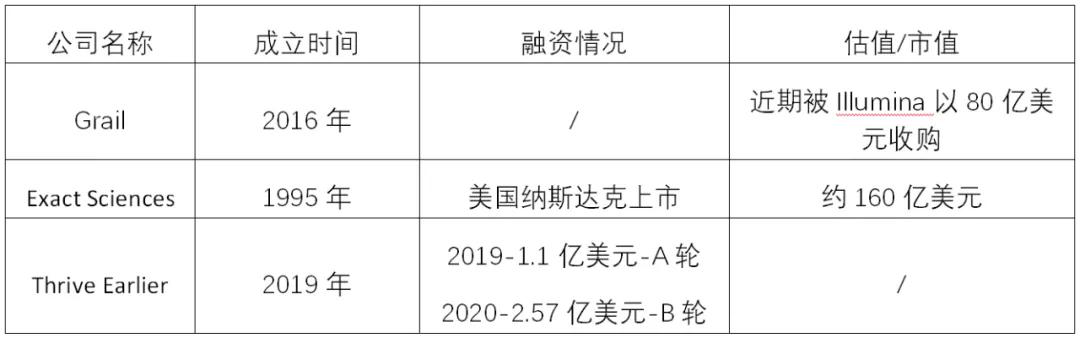
表1. 部分获得突破性医疗器械认定的肿瘤早筛公司。
此次泛生子的肝癌早筛产品HCCscreenTM获得“突破性医疗器械”认定,一方面说明了美国监管机构对泛生子液体活检早筛技术的高度认可,另一方面也印证着肝癌早筛巨大的临床意义和社会价值。
技术:Best-In-Class
HCCscreenTM液体活检产品核心技术源于泛生子自主研发的创新技术Mutation CapsuleTM,该技术可以同时检测外周血中游离DNA的多种甲基化和基因突变信息。泛生子在4500名澳抗阳性患者的前瞻性队列研究中进一步验证HCCscreenTM,其中一个中心的297名患者的初步数据显示,HCCscreenTM实现了92%的灵敏度、93%的特异性,实现了35%的阳性预测值(PPV)、99.6%的阴性预测值(NPV,是验证早筛技术同样重要的指标,但很少公司披露),显著优于目前临床上的“金标准”——超声检查联合甲胎蛋白(AFP)检测,该技术特异性达到99%,但灵敏度仅60%多,尤其在检测早期肝癌方面表现更低。也就是说,通过泛生子的血液检测,可以多检出50%左右的肝癌患者,大幅降低漏检率。
此外,按照肿瘤大小分类,在初步数据诊断出的12名肝癌患者中,10名患者的肿瘤小于5厘米,说明HCCscreenTM能灵敏地诊断出早期肝癌。泛生子预计将在2021年上半年公布2,000名患者前瞻性队列的完整数据,值得期待。
横向对比,根据全球老牌早筛公司Exact Sciences的多中心、回顾性研究,其采用的甲基化联合蛋白质的肝癌早筛检测灵敏度为80%,特异性为90%,低于泛生子的前瞻性研究数据。一般来说,由于各种原因,前瞻性研究的数据想要优于回顾性研究是非常困难的。 泛生子的前瞻性研究数据不亚于同类产品的回顾性研究数据给了我们更多理由期待HCCscreenTM作为现有超声+AFP的替代性方案——而非补充性技术——在临床中取得更加优异的表现。

表2. 泛生子与Exact Sciences部分数据对比。
临床与社会价值:肿瘤精准医疗的圣杯,百亿美元潜在市场
肝癌是人类健康的重大威胁。全球范围内,肝癌在所有癌症中致死率排名第四,发病率位列第六[3]。中国的每年新发病人约393,000人,每年死亡人数约369,000人,发病数量位居全球之首,几乎占全球总数的一半。根据Frost&Sullivan 2019年调研数据,中国约有1.2亿肝癌高危人群,其中约7400万为乙肝病毒携带者。在美国,肝癌是排名第五的致死癌症,且每年以2%-3%的速度增长。2020年美国新增肝癌预计为42,810例,死亡30,160例[4]。肝细胞癌(HCC)是肝癌中最常见的类型,占85–90% [5]。晚期肝癌的治疗不甚理想,一年生存率不到50%,五年生存率仅为10%[6]。肝癌给患者、家庭和社会带来了巨大负担,早期诊断、早期发现是一项亟需满足的临床需求,也是减轻肿瘤负担的必经之路,堪称肝癌精准医疗的圣杯。
目前中美两国对HCC风险人群推荐的临床筛查手段为定期进行超声检查,可选择同时检查甲胎蛋白[7]。考虑到泛生子肝癌早期筛查在先期数据中展现出来的巨大性能优势,仅在中美两国,基于血液检测的肝癌早筛潜在市场规模即可超百亿美元(10%渗透率,检测频率2次/人/年)。事实上,不论是对于国家医保还是患病家庭,相比于中晚期肿瘤诊疗所产生的巨大支出,早筛早诊无疑是更加经济、更有效率的选择,必将成为肿瘤防控的中流砥柱。
“突破性医疗器械”认定对于泛生子和肿瘤早筛行业意味着什么?
基于肝癌早筛的巨大价值,此次泛生子获得“突破性医疗器械”认定,无论对于该产品的开发和上市,还是对于整个肿瘤早筛领域的发展都有着重要的意义。
泛生子将获得与美国FDA更多的、更深入的沟通机会和更快的反馈速度,可确保后续临床方案设计等方面不走弯路,取得宝贵的时间优势。
HCCScreenTM的上市申请将获得优先审核。根据配套的突破性医疗器械计划,获得认定后,泛生子一旦与FDA就数据开发计划(Data Development Plan,DDP)达成一致,未来产品在美获批上市的路径将变得非常清晰和确定。
在美国,NGS检测产品的推广更依赖于医疗保险的覆盖。一旦认定器械取得上市审批,该产品将立刻进入美国医疗保险和医疗补助服务中心(Center for Medicare and Medicaid Services, CMS)下的联邦医疗保险。
获得美国“突破性医疗器械”认定意味着泛生子的液体活检早筛技术得到了国际权威的肯定。随着中国报证工作的运行,美国产品申报的经验也可助一臂之力,并进一步优化自身产品研发及上市流程,给公司整体发展带来持久和深远的影响。

图2. FDA突破性医疗器械计划可以提供审核优先权和额外的审核资源。
在获得美国FDA“突破性医疗器械”门槛如此高的情况下,泛生子HCCscreenTM为我国肿瘤精准医疗领域打了一剂强心剂,堪称领域内的里程碑事件。在可预见的未来,泛生子与美国FDA关系不断深化、产品商业化之路不断明朗、盈利模式不断清晰,更可看到泛生子癌症早筛业务线坚实的后坐力,也期待泛生子在其他癌症早筛上的表现。
对于肿瘤早期筛查来说,技术门槛高,研发、验证和审批周期较长,在技术的“无人区”开疆拓土是业内公司的常态。因此,为最具突破性、引领性和临床价值巨大的产品开辟新的上市路径是值得商讨的话题。通过与监管机构高效的沟通,支持临床试验数据的拓展性使用,将会有力地促进技术创新和成果转化。在审评资源有限的条件下,这些新的监管思路和方法可以支持和引导更多创新技术去覆盖未满足的临床需求,惠及广大患者。

图3. 泛生子于今年6月美国纳斯达克挂牌上市 达成全球癌症精准医学领域最大IPO(绿鞋前)。
参考文献:
1.Breakthrough Devices Program Guidance for Industry and Food and Drug Administration Staff. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/breakthrough-devices-program
2.仉琪, 姜雨萌, 李耀华. 美国FDA突破性器械项目政策介绍及对我国的启示[J]. 中国医疗器械信息, 2020, v.26(01):6-8.
3.Villanueva, A. Hepatocellular Carcinoma. N. Engl. J. Med. 2019, 380, 1450–1462.
4.National Institute of Health. https://seer.cancer.gov/statfacts/html/livibd.html
5.Wong MCS, et al. (2018) The changing epidemiology of liver diseases in the Asia-Pacific region. Nature reviews. Gastroenterology & hepatology.
6.Altekruse SF, McGlynn KA, Reichman ME. Hepatocellular carcinoma incidence, mortality, and survival trends in the United States from 1975 to 2005. J Clin Oncol 2009;27:1485-91.
7.Harris PS, Hansen RM, Gray ME, et al. Hepatocellular carcinoma surveillance: An evidence-based approach. World J Gastroenterol. 2019:25(13):1550-1559.







